Вода играет существенную роль в производстве меха и кожи. По количеству она занимает первое место среди всех вспомогательных материалов.
Вода оказывает существенное влияние на ход многих процессов кожевенного производства. Доброкачественность готовой кожи и меха в значительной степени зависит от правильности обработки кожевенно-мехового сырья в мокрых цехах. Поэтому необходимо знать состав воды, ее естественную температуру и влияние времени года на эти показатели.
Различают воду: атмосферную, грунтовую и поверхностную (из ручьев, рек, озер).
Атмосферная вода
Атмосферная вода падает на землю в виде дождя и снега и представляет собой наиболее чистую почти дистиллированную воду.
Атмосферная вода содержит лишь незначительные количества частиц пыли, углекислоты, кислорода, дыма, увлеченных ею из воздуха.
Она почти совсем не содержит солей щелочноземельных металлов и является очень мягкой. Сухой остаток в 1 литре дождевой воды составляет в среднем, по данным многих исследований, около 40мг.
Регулярное потребление дождевой воды для кожевенного производства невозможно ввиду незначительности ее количества. По составу к дождевой воде близко подходит конденсационная.
Грунтовая вода
Так называется вся вода, находящаяся в земле. На поверхность земли она получает выход в виде ключей или через буровые скважины и простые колодцы.
Свойства грунтовой воды зависят от слоев земли, через которые она протекает, и от процессов, которые совершаются при соприкосновении воды с верхним слоем земли.
На земном шаре весьма распространен углекислый кальций, образующий в иных местах мощные меловые отложения и горные кряжи. Мел большей частью перемешан с углекислым магнием, особенно в доломитах. Эти углекислые соединения, в особенности кальциевые, лишь слабо растворяются в воде, но в ней содержится много свободной углекислоты, под действием которой одноугле кислые соединения (карбонаты) переходят в значительно более растворимые двууглекислые кальций и магний (бикарбонаты).
Железо, марганец и алюминий, хотя и реже и в меньших количествах, также переходят в присутствии свободной углекислотьх в растворимый бикарбонат, при этом в грунтовой воде остается еще много свободной углекислоты, хотя меньше, чем в поверхностной.
Растворы двууглекислого кальция (и других бикарбонатов) постоянны лишь при наличии необходимого минимума свободной угольной кислоты. Величина этого минимума зависит от концентрации бикарбоната.
Проникая в почву, вода выщелачивает растворимые соли (хлористый натрий, сернокислый магний). Гипс (или ангидрид) растворяется в воде легче, чем углекальциевая соль (приблизительно 1 часть в 400 частях воды), причем не нуждается для растворения в углекислоте. Он, следовательно, переходит в раствор там, где вода протекает через гипсовый слой.
Из лесных грунтов в воду переходят органические (гуминовые) вещества. Углекислота, образующаяся в почве в результате процессов гниения, также поглощается водой и участвует в образовании бикарбонатов из известняка и углекислого магния.
Продукты распада органических остатков, как и попадающие в почву в населенных местах экскременты и хозяйственные отбросы, подвергаются в конечном счете в почве процессу минерализации, обогащая воду бикарбонатами, сульфатами, нитратами, фосфатами и другими соединениями.
Бактерии, в большом количестве содержащиеся в самых верхних слоях почвы, удерживаются при просачивании воды через глубокие слои почвы, так что на глубине 4 м вода уже содержит очень мало микроорганизмов.
В более глубоких слоях земной коры количество органических веществ уменьшается, частью задерживаясь верхним почвенным слоем вследствие происходящих в нем коллоидальных, адсорбционных процессов. Уменьшается также содержание кислорода и количество микроорганизмов. Подпочвенная вода обычно свободна от механических примесей.
Большая часть перечисленных выше соединений - фосфаты, азотсодержащие органические вещества, аммиак, а также калийные соли, удерживается почвой и поглощается корнями растений, в растворе же остаются и попадают в колодезную воду хлориды, сульфаты и нитраты.
Присутствие в воде в значительных количествах хлора, который попадает в почву с мочей животных и людей, свидетельствует об ее загрязнении экскрементами. Возможно также просачивание воды через грунты, содержащие хлориды.
Состав колодезной воды колеблется в значительных пределах в зависимости от времени года, от расхода и притока дождевой воды. Вообще колодезные воды по сравнению с водами открытых водоемов имеют более низкую температуру и более значительную жесткость, меньше содержат микроорганизмов и кислорода.
Чем глубже колодец, тем сильнее выражено это различие в свойствах воды.
Поверхностная вода
Поверхностные воды ручьев, рек н озер, как и грунтовые воды, отличаются разнообразием состава в зависимости от почвенных, климатических и других условий. Обычно они содержат значительно меньше растворенных солей, чем грунтовые воды. Летом и зимой поверхностные воды более богаты растворенными солями и содержат меньше механических примесей и взвешенных веществ, чем в весенние и осенние паводки.
Нормальный состав речной воды может значительно изменяться, например при сильных ливнях, в особенности в гористых местностях вследствие попадания в нее частиц земли и содержащихся на поверхности последней растворимых солей. Речные воды часто загрязняются хозяйственными и промышленными сточными водами населенных мест.
Речные и озерные воды отличаются от колодезных большим содержанием микроорганизмов, более высокой температурой и меньшим постоянством состава в различные времена года.
Жесткость воды и ее причины
Наиболее часто в природных водах встречаются следующие минеральные вещества: бикарбонаты кальция, бикарбонат магния, углекислый кальций, сернокислый кальций, сернокислый магний, хлористый кальций, хлористый магний, хлориды и сульфаты щелочных металлов, бикарбонат железа, углекислота.
Двууглекислые соли кальция и магния (бикарбонаты) создают "карбонатную жесткость", которую иногда называют также "временной жесткостью", ввиду того, что при кипячении воды бикарбоната кальция разлагается с выделением СО2 и осаждением из раствора СаСОЗ, в результате чего карбонатная жесткость исчезает. При более длительном кипячении разлагается и бикарбонат магния.
Прочие соли кальция и магния дают "постоянную жесткость". Жесткость, вызываемую солями магния, целесообразно обозначать особо как "магнезиальную жесткость". Сумма карбонатной и постоянной жесткости составляет "общую жесткость" воды.
Углекислота может содержаться в воде в свободном, полусвязанном (бикарбонаты) и связанном (карбонаты) состоянии. Содержание свободной углекислоты в воде может быть весьма значительным, так как ее растворимость в воде очень велика: в 1 литре воды при 15С »растворяется около 1 литра СО2. Много углекислоты содержится в естественных минеральных водах.
Свободная углекислота в воде подразделяется на активную и неактивную. Активной является та часть углекислоты, которая переводит карбонат кальция в растворимый бикарбонат, действует разъедающе на свинец и железо, а неактивной - та часть углекислоты, которая находится в состоянии равновесия с бикарбонатами и нужна для предохранения последних от разложения и удержания бикарбонатов в растворе.
Количество неактивной углекислоты зависит от карбонатной жесткости данной воды. Степень жесткости воды выражается в градусах жесткости.
Согласно принятой у нас шкале жесткости одному градусу соответствует содержание в 1 литре воды 10 мг СаО.
Для справки:
- 1 января 2014 года в России введён межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жёсткости». По новому ГОСТу жёсткость выражается в градусах жесткости (°Ж). 1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л).
Углекислота встречается в воде преимущественно полусвязанной с кальцием и магнием в виде бикарбонатов. В грунтовой и очень жесткой воде свободная, т.е. активная, углекислота совсем отсутствует. Мягкая же вода очень часто содержит большое количество свободной активной углекислоты (от 40 мг/л и больше).
Химический состав воды, т.е. содержание растворенных в ней минеральных веществ, а также примеси органических веществ в виде взвешенных частиц и гнилостные бактерии (в воде из озер и болот) влияют на качество голья и готовой кожи.
Известны случаи, когда одна и та же методика выработки меха и кож дает на разных заводах совершенно различные результаты в отношении качества готовой продукции. Это различие в значительной степени обусловливается различными свойствами производственной воды. После химической очистки производственной воды качество выпускаемой заводом готовой продукции резко улучшилось.
Важное значение качества воды и необходимость ее подготовки для технологических целей еще недостаточно осознаны инженерно-техническими работниками кожевенно-меховых заводов. Правильное применение воды на таких производствах затрудняется тем, что одна и та же вода в одной части технологического процесса может оказаться вполне пригодной, а в другой может вызвать значительные повреждения продукции.
Способы умягчения воды для кожевенно-мехового производства
Для очистки воды наиболее часто применяют следующие химические способы.
Способ 1-й - известково-содовый.
Прибавлением к воде извести устраняют двууглекислые соли кальция и магния (карбонатную жесткость). Постоянную (некарбонатную) жесткость устраняют прибавлением соды.
Способ 2-й - пермутитовый.
Пермутит представляет собой искусственный цеолит, приготовляемый сплавлением 3 частей каолина, 6 частей кварца и 12 частей соды. Получается двойной алюминиево-натриевый силикат, в котором большая часть натрия связана с алюминием, причем натрий может замещаться более тяжелыми металлами, например кальцием, магнием и железом. На этой способности к замещению и основано умягчающее действие пермутитов.
Для умягчения воды устраивают фильтры цилиндрической формы. Фильтрующим материалом является древесная стружка или гравий, смешанный с пермутитом. Вода должна протекать через фильтр со скоростью 2-З м/час.
Пригодную для кожевенного производства воду можно получить, применяя комбинированный метод умягчения. Карбонатную жесткость устраняют по известковому способу, затем воду, если она имеет постоянную жесткость, пропускают через пермутитовый фильтр, для устранения некарбонатной жесткости.
В процессе умягчения воды натриевый пермутит превращается в кальциевый и магниевый. По мере использования натриевого пермутита его восстанавливают (регенерируют) поваренной солью. Через фильтр пропускают подогретый 10%-ный раствор поваренной соли.
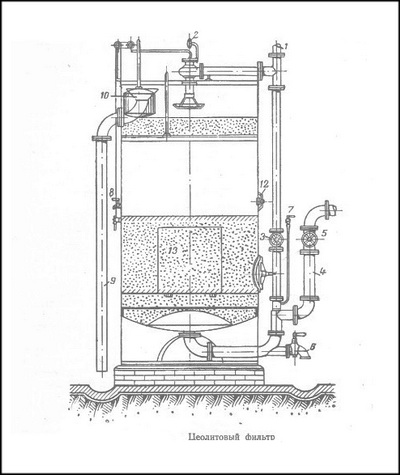 На рисунке изображен открытый цеолитовый фильтр. Цеолит помещается между слоями гравия, служащими для предохранения от уноса пермутитового песка током воды. Верхний слой гравия служит, кроме того, фильтром для удержания взвешенных веществ.
На рисунке изображен открытый цеолитовый фильтр. Цеолит помещается между слоями гравия, служащими для предохранения от уноса пермутитового песка током воды. Верхний слой гравия служит, кроме того, фильтром для удержания взвешенных веществ.
Вода для умягчения поступает на фильтр сверху по трубе 1. Напор ее регулируется шаровым клапаном 2. Мягкая вода выпускается по трубе 4 через кран 5. Для промывки цеолита служит кран 6. Промывку производят сверху вниз. Через кран 7 при регенерации спускается раствор поваренной соли. Жесткая вода перед регенерацией выпускается через кран 8.
Пермутитовый песок разрыхляется сильным током воды. Во время работы фильтра краны 2 и 5 открыты, краны 3, б, 7 и 3
закрыты. Неумягченная вода стоит на определенном уровне благодаря шаровому клапану 2. Скорость ее регулируется от руки краном 5 или автоматически шаровым клапаном с поплавком.
Когда цеолит фильтра сработался, закрывают кран 5 и впуск воды в фильтр прекращают. Перед регенерацией цеолит разрыхляют, для чего быстро открывают кран 3 и оставляют его на некоторое время открытым, затем так же быстро закрывают.
Далее выпускают воду над цеолитом через кран 8 и пускают на цеолит определенное количество раствора поваренной соли в течение 2-4 часов. Скорость пропускания через фильтр раствора поваренной соли при регенерации пермутитового песка должна быть в 2-4 раза ниже, чем при фильтровании умягченной воды.
По прекращении притока раствора соли цеолит остается под раствором хлористого натрия еще 4-8 часа. После этого регенерация считается законченной. Кран 7 закрывают и открывают кран б. Током воды поваренную соль вытесняют из цеолита. После такой промывки, продолжающейся 5-10 мин., кран 6 закрывают. Затем пермутитовый фильтр снова пускают в работу, для чего открывают кран 5. Во время работы фильтра краны 3, б, 7 и 8 закрыты. Во время регенерации краны 2, 3, 5, 6 и 8 закрыты, кран 7 открыт.
Положительная сторона пермутитового способа умягчения воды заключается в сравнительной простоте описанного устройства. В том, что для умягчения не требуется подачи реактивов, так как процессы умягчения происходят в самой фильтрующей среде (пермутите).
Недостатком пермутитового способа является следующее.
Так как реакция умягчения воды в пермутитовых аппаратах происходит в самом пермутите, то является естественной необходимость сохранять его зерна в чистоте. При умягчении мутной воды, содержащей взвешенные вещества, последние обволакивают пермутитовый песок, что ведет к потере им обменной способности.
Поэтому при умягчении мутной воды, загрязненной механическими примесями, хотя бы даже в малых количествах (а такая вода применяется в подавляющем большинстве случаев), ее необходимо предварительно фильтровать до полного осветления.
Пригодность воды для отдельных процессов кожевенного производства
Вода для отмоки.
В литературе имеются указания, что хлориды, сульфаты кальция и магния, содержащиеся в воде, при отмоке ускоряют, а бикарбонаты замедляют обводнение шкур. Но на практике установлено, что неорганические составные части воды для отмоки не имеют большого значения. Жесткость воды на продолжительность размачивания шкур влияет очень мало. Гораздо большее значение имеет загрязненность воды органическими веществами. Загрязненной является вода из открытых водоемов, болот, прудов и рек. Она содержит гнилостные бактерии. Кроме того, поверхностные воды в летнее время имеют высокую температуру.
Сама по себе высокая температура для отмоки не вредна, но она способствует быстрому размножению бактерий, которые разрушают шкуру весьма сильно и быстро.
Там, где проявляется вредное действие гнилостных бактерий, где при отмоке вынуждены пользоваться теплой водой, необходимо применять антисептики. Подробнее об этом можно прочитать в материале описания процесса отмоки.
Вода для золения.
Значение воды при золении зависит от применяемого метода обработки. Если используются известковые зольники, карбонатная жесткость не вредна, так как удаляется известью. При золении же без извести, чистыми растворами сернистого натрия умеренной концентрации высокая карбонатная жесткость вредна, так как при пользовании ею устраняется один из продуктов гидролиза сернистого натрия (NаОН), что снижает обезволашивающее действие зольника.
На сильно обостренные зольные жидкости различие в свойствах воды не влияет.
В щелочных зольниках, сильно обостренных сернистым натрием или в чистых растворах сернистого натрия, гнилостные бактерии обезвреживаются. В старых зольных жидкостях, которые совсем обострены или содержат меньше 1 г/л сернистого натрия, бактерии могут содержаться и развиваться, приспособившись к щелочности. Поэтому для слабо щелочных зольников желательно применять воду, свободную от гнилостных микроорганизмов.
Вода для промывки зольного голья.
Карбонатная жесткость причиняет значительный вред при промывка зольного голья на проточной воде, особенно в тех случаях, когда промывка по технологическим условиям требует длительного времени (1,5-2 часа).
В результате взаимодействия бикарбонатов кальция и магния с известью гольевой ткани на поверхности голья осаждается углекислый кальций, лицо голья становится шероховатым. Такое голье плохо поддается мягчению, так как проникновению ферментов в его толщу препятствует слой углекислого кальция. Процесс затягивается и в результате получается непромягченное голье.
Вода для мягчения.
Карбонатная жесткость замедляет процесс мягчения. Поэтому воду, предназначенную для мягчения, также рекомендуется обрабатывать известью.
Вода для пикелевания, дубления и нейтрализации.
На пикелевание, хромовое дубление и нейтрализацию состав воды не оказывает существенного влияния, и для выполнения этих операций можно применять любую воду. Надо только при даче кислоты учитывать то обстоятельство, что при высокой карбонатной жесткости часть кислоты, пикеля и хромовых соков идет на нейтрализацию щелочности воды. Ґнилостные бактерии обезвреживаются кислотой.
Вода для крашения.
Особенно необходима чистая, мягкая вода для крашения, при котором карбонатная жесткость доставляет наибольшие затруднения. Если вода содержит большое количество двууглекислой извести и двууглекислой магнезии, то эти соли вступают в реакцию с красителями, особенно с основными, которые образуют хлопьевидные осадки. Последние вызывают неравномерность крашения, образуют пятна и полосы, а краситель частично теряется.
Воду, предназначенную для растворения основных красителей и для крашения, надо корректировать уксусной или муравьиной кислотой. Кислота нейтрализует щелочность воды и препятствует образованию осадков. На каждые 100 литров воды и каждый градус переменной жесткости требуется 7,2 см3 уксусной кислоты плотностью 5,4° Вё, или 4,4 см3 уксусной кислоты плотностью 8° Вё, или 6,4 см3 муравьиной кислоты плотностью 89° Вё. `
На кислотные и прямые красители карбонатная жесткость не оказывает вредного воздействия, а постоянная жесткость снижает растворимость некоторых кислотных и прямых красителей, и окраска часто получается тусклой.
Мутная вода, содержащая большое количество взвешенных частиц, для крашения мало пригодна, она вызывает неравномерность окраски и приводит к потере красителей. Мутную воду надо фильтровать или осветлять отстаиванием.
Вода для жирования.
Постоянная и карбонатная жесткость вредно влияют на жирование. С мылом, входящим в состав жировой эмульсии и с несульфированными жирами соли кальция и магния образуют нерастворимые в воде соединения. Известковое и магнезиальное, а также железное мыла представляют собой липкую массу, которая обволакивает поверхность кожи, образует на ее лице жирные пятна и причиняет большие трудности при отделке кожи. Лощение кожи на машине затрудняется, снижается и качество отделки.
Если производственная вода для крашения и жирования жестка, необходимо смешивать ее с конденсатом и таким образом снижать общую жесткость, или применять только конденсат, химические методы, описываемые в некоторых книгах по кожевенному производству, непригодны для умягчения воды, применяемой для крашения и жирования, так как эти методы дают сильно щелочную воду.
Вода для аппретур и глянцев.
Для приготовления аппретур и глянцев также необходимо применять мягкую воду.
Известны случаи, когда при отделке коричневого шевро казеиновой аппретурой, приготовленной на воде с общей жесткостью в 20°, на лице кожи появлялся белый налет и при лощении не удавалось получить достаточный блеск.
Контроль умягченной воды
Перед применением умягченной воды следует проконтролировать результаты ее обработки. Необходимо определить жесткость воды и щелочность.
Как избыток, так и недостаток щелочей вредны: при недостатке щелочей не достигается понижение жесткости, большой избыток щелочей вредно действует на голье, небольшой же избыток СаО для промывки и мягчения голья не вреден.
Поэтому необходимо добиваться минимума жесткости при минимуме щелочности.
Простейший контроль щелочности умягченной воды осуществляется титрованием 0,1 N раствором соляной или серной кислоты.
Прибавление фенолфталеина иногда придает умягченной воде красную окраску, что может зависеть от избытка извести или углекислой магнезии. Это устанавливается титрованием 100 см3 воды 0,1 N раствором соляной кислоты в присутствии фенолфталеина,а затем - метилоранжа. Если титр, установленный на фенолфталеине, отличается от титра, установленного на метилоранже, не более чем на 0,1-0,2 см3, значит в избытке имеется известь. Если же разницы между титрами значительна, то в воде имеются еще неосажденные углекислотные соли.
комментарии